何宏轩研究组在流感病毒感染机制研究中取得重要进展
A流感病毒是一种高度传染性和致病性的病毒,人类和多种动物均易感。病毒在宿主细胞内的有效复制,其根本在于病毒在不同的感染阶段与宿主的多种不同蛋白发生相互作用,以抑制或促进细胞信号通路的激活。
在转录后调控中,SUMO化蛋白(小泛素样修饰,Small Ubiquitin-like MOdifier)对靶蛋白的修饰是调控蛋白活性、稳定性、细胞内定位和蛋白质互作的一个重要机制。以往的研究表明流感病毒在感染期间广泛与宿主细胞内的SUMO化系统发生作用,主要集中在病毒本身蛋白,如NS1, NS2, PB1, NP 和 M1。但是,病毒感染后宿主细胞蛋白的SUMO化状态以及宿主蛋白的SUMO化对病毒感染有何影响?仍不清楚。
中国科学院动物研究所野生动物疫病研究组何宏轩研究员带领团队,在流感病毒感染对宿主细胞蛋白SUMO化影响进行了探索性研究。研究团队利用细胞感染模型和质谱方法,对病毒感染细胞SUMO化蛋白进行了分析鉴定,发现宿主细胞的MEK1蛋白是SUMO1的靶蛋白,MEK1蛋白的SUMO化程度受到H5N1病毒感染的调控。进一步观察发现,提高MEK1的SUMO化水平会显著抑制病毒的感染,而下调MEK1的SUMO化水平会明显促进病毒的复制水平。进一步研究发现提高流感病毒HA蛋白在细胞膜的表达会促进MEK1蛋白的磷酸化,同时逐渐降低MEK1蛋白的SUMO化。因此该研究揭示了一个流感病毒通过抑制宿主细胞信号通路来促进病毒复制的新机制,为未来通过研究能够促进宿主细胞SUMO化的制剂来治疗和预防流感病毒具有重要的理论意义。
该研究于 2017年2月6日以“HA Triggers the switch from MEK1 SUMOylation to Phosphorylation of the ERK pathway in influenza A virus-infected Cells and facilitates its infection”为题在线发表于Front. Cell. Infect. Microbiol(IF=5.218)(论文链接)。本文的第一作者为王承民,刘慧敏和罗静为同等贡献作者,通讯作者是何宏轩研究员。本项目得到国家重大研发计划(2016YFD0500300)和国家现代农业产业技术体系北京市家禽创新团队(CARS-PSTP)项目的资助。
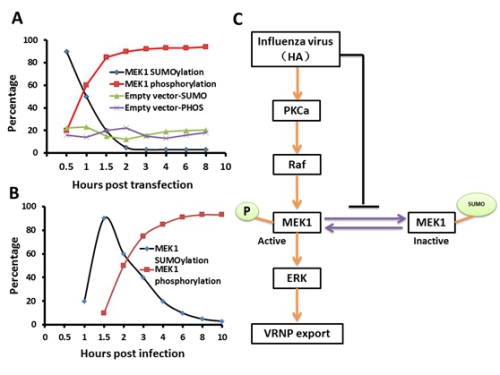
一种特异的SUMO化ERK信号通路的负调控原理模型。在HA表达处理(A)和病毒感染处理(B)的条件下,MEK1 SUMO化和磷酸化的动态变化表现出类似的趋势,但在病毒感染处理显然滞后于膜表达HA处理。因此我们提出一个模型假设,即流感病毒激活ERK信号通路受到SUMO化MEK1的负调控(C)。流感病毒通过HA下调调控ERK通路中MEK1 SUMO化修饰促进vRNP出核进而促进其感染,即HA是ERK通路从MEK1 SUMO化到磷酸化的开关。