詹祥江实验室阐明RNA复杂性产生的新机制
转录本多样性在有机体功能多样性方面扮演着至关重要的角色,但目前对于其产生机制及生物意义仍不清楚。近期,中国科学院动物研究所詹祥江实验室通过分析猎隼的血液转录组和甲基化组、家鸡以及小鼠多组织转录组,揭示了一个转录本多样性产生的新机制。
该研究发现表达量越高的基因越倾向于拥有更多的转录本。对猎隼血液中表达量最高的4个血红蛋白基因的分析结果显示,尽管它们的外显子数目不超过三个,却能通过可变剪切产生上百个不同的转录本,并且大部分剪切并不是发生在已有的基因组剪切位点(authentic splice site)上,而是与新产生的剪切位点(de novo splice site)有关。进一步的研究表明,这些新的剪切位点是通过转录过程中DNA的突变(transcription-associated mutation, TAM)引起的。这一结果改变了业界普遍认为的“RNA编辑(RNA editing)是新剪切位点产生的主要方式”这一观点。
同时,该研究通过分析DNA甲基化与TAM之间的空间关系,发现在转录过程中DNA甲基化可能会抑制TAM的产生,表明DNA甲基化不仅对基因表达具有调控作用,还会影响新剪切位点的产生。这一发现拓展了学界对于DNA甲基化功能的认知。此外,该研究通过对猎隼青藏高原和低地种群血红蛋白转录表达谱的差异分析,首次发现青藏高原种群拥有更多中高度表达的血红蛋白转录本,这可能有利于猎隼更好地适应高原低氧环境。
本研究工作首次阐明了新的可变剪切位点产生的主要方式是TAM,同时也表明了TAM所引起的RNA多样性可能为物种适应性进化提供了另外一条策略。该项研究工作以“Transcription-associated mutation promotes RNA complexity in highly expressed genes-a major new source of selectable variation”为题于2018年2月7日在Molecular Biology and Evolution 杂志发表(doi.org/10.1093/molbev/msy017)。文章第一作者为动物所博士研究生潘胜凯,詹祥江研究员为通讯作者。该工作得到了中国科学院B类先导专项、国家重点研发计划项目、国家自然科学基金优秀青年基金、“中国科学院动物进化与遗传前沿交叉卓越创新中心”等项目和计划的资助。
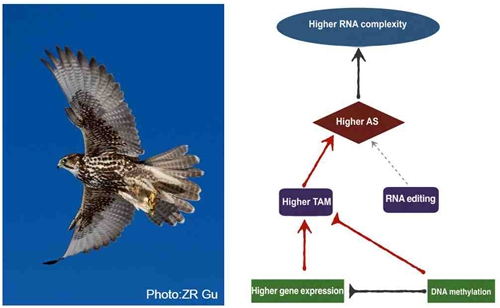
猎隼(左);高表达基因产生高RNA多样性的机制(右)
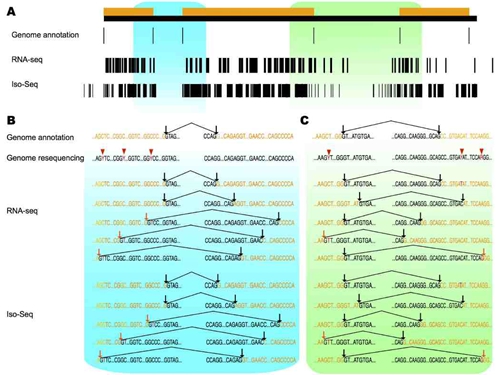
猎隼血红蛋白中TAM产生多个新可变剪切位点
